在人类的疾病中,由鸟嘌呤(G)向腺嘌呤(A)的突变极为常见。类似的突变能在罹患局灶性癫痫(focal epilepsy)、杜氏肌营养不良、或是帕金森病的患者体内找到。因此,如果能逆转这一常见突变,把A矫正回G,就有望从根源上治疗这些疾病。
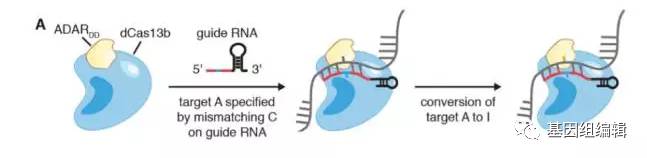
腺嘌呤在脱氨后,会变成一种叫做肌苷的分子,而它与鸟嘌呤的结构非常接近。只要能让关键的腺嘌呤脱氨,就能完成从A到G的矫正。
为了达成这个目标,张锋教授团队在CRISPR-Cas13的家族中开始寻找潜在的工具。与常见的Cas9不同,Cas13蛋白只靶向RNA,不会影响到基因组的遗传信息,从而进一步增加了基因编辑的安全性。在一番搜寻后,他们发现来自普雷沃菌(Prevotella bacteria)的Cas13b蛋白靶向RNA的活性最佳。随后,研究人员做了几个小改动,让Cas13b蛋白失去了“剪切”的能力,并把它和一种叫做ADAR2的酶融合到了一款。在人体中,ADAR2能够把RNA上的腺嘌呤转变为肌苷。
在细胞看来,肌苷与鸟嘌呤别无二致,因此就能按鸟嘌呤处理,合成具有正常生理功能的蛋白质。这套系统被命名为“可编程的腺嘌呤到肌苷RNA编辑”(RNA Editing for Programmable A to I Replacement),缩写为REPAIR。
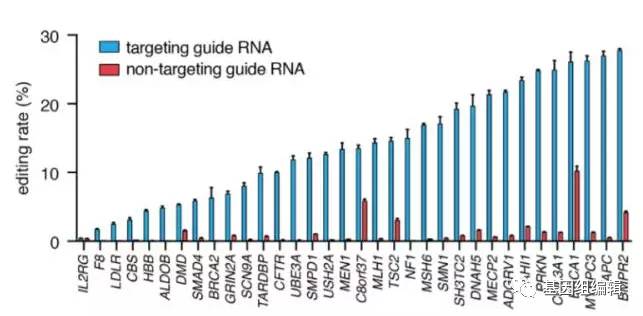
为了检验这一系统的治疗潜力,该团队在人类细胞中引入了能导致范可尼贫血症(Fanconi anemia)和X连锁肾源性尿崩症(X-linked nephrogenic diabetes insipidus)的致病突变,并检测其能否对其进行有效的修复。结果表明,在RNA的水平上,这些突变可以被有效矫正,这也从概念上支持了这套系统的可行性。
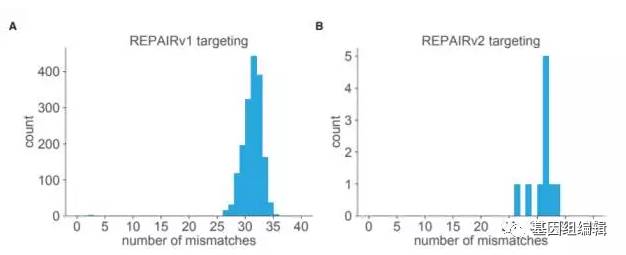
在开发出REPAIR后,张锋教授的团队进一步提高了它的特异性。在一系列的修饰后,这套系统的特异性大大提高,把全转录组中的可检测脱靶编辑数从18385锐减到20!在测试中,这款被称为REPAIRv2的系统编辑RNA的效率最高可达51%。
原文标题:
RNA editing with CRISPR-Cas13
Nucleic acid editing holds promise for treating genetic disease, particularly at the RNA level, where disease-relevant sequences can be rescued to yield functional protein products. Type VI CRISPR-Cas systems contain the programmable single-effector RNA-guided RNases Cas13. Here, we profile Type VI systems to engineer a Cas13 ortholog capable of robust knockdown and demonstrate RNA editing by using catalytically-inactive Cas13 (dCas13) to direct adenosine to inosine deaminase activity by ADAR2 to transcripts in mammalian cells. This system, referred to as RNA Editing for Programmable A to I Replacement (REPAIR), which has no strict sequence constraints, can be used to edit full-length transcripts containing pathogenic mutations. We further engineer this system to create a high specificity variant and minimize the system to facilitate viral delivery. REPAIR presents a promising RNA editing platform with broad applicability for research, therapeutics, and biotechnology.
特别声明:本文来源于"基因组编辑",仅仅是出于传播信息的需要,作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。