基因组分析鉴定胰腺癌分子亚型
Genomic analyses identify molecular subtypes of pancreatic cancer
杂志:NATURE, 2016
影响因子:38.138
【研究背景】
由于存在大量变异,癌症往往表现出不稳定性,近期通过对456个胰腺癌患者的全基因组以及外显子深度测序分析发现胰腺癌的突变机制以及一些重要的候选基因,同时,通过RNA表达谱发现胰腺癌的四个亚型以及它们的转录调控网络。文章描述了这四种亚型的不同的基因和表观特征,从而有利于进一步推断其分子进化机制。
【实验设计】
实验样本:病人资料采集和提取自澳大利亚胰腺癌基因组计划(APGI),经过人类研究伦理审批之后,进行组织解剖、RNA和DNA的提取。对于癌细胞数>40%的样本进行全基因组测序(覆盖率75×),对细胞数在12%-40%的样本进行外显子深度测序(覆盖率400×),对照组为正常人。
测序方法:建库(外显子库、全基因组库、RNA库),Illumina HiSeq 2000/2500进行测序
技术路线:
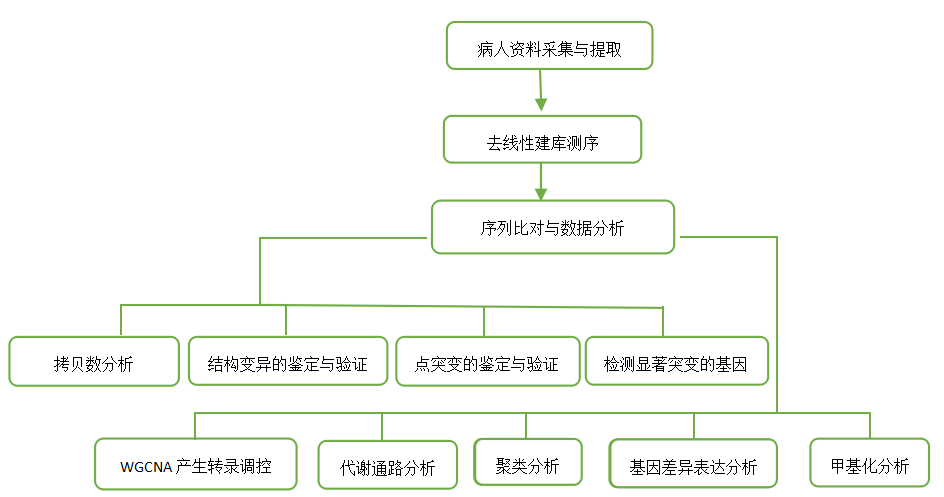
【研究结果】
1、 从分子类型以及转录调控网络角度定义PDAC(胰腺导管腺癌)
对RNA-seq做聚类分析,发现4个PDAC类型: squamous、ADEX、pancreatic progenitor以及immunogenic(如图1a);用WGCNA(加权基因表达网络分析)产生转录表达网络,发现26个代表不同生物过程的基因簇(gene programmes),图1b可以看到PDAC中明显富集的基因簇,其中10个(黑点)可明显区分4类PC。图1b还反映出四个描述squamous亚型的基因簇,包括参与一些特定生物过程的基因簇,比如免疫、缺氧反应、代谢重整、TGF-β信号通路、MYC通路激活、TP63∆N和靶标基因的自噬和上调表达。
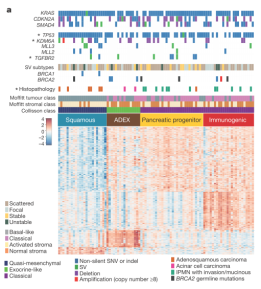

图1 从分子及转录调控网络水平对PDAC四种亚型进行定义。a. RNA-seq聚类分析发现4类PDAC亚型:squamous(蓝色);ADEX (abnormally differentiated endocrine exocrine; 棕色); pancreatic progenitor(黄色);immunogenic(红色)。*P < 0.05, Fisher’s exact test. b. 对PDAC中富集的基因簇做热图,黑色的点表示转录表达网络中对每个亚型具有重要意义的基因簇。
squamous亚型的特征描述
使用TCGA(癌症基因组表达谱)的pan-cancer研究数据,做箱线图,得到PDAC squamous亚型的特征分数(如图2a),发现在C2-squamous-like class中表达量最高,所以命名为squamous亚型。对突变基因的子网络分析发现,Squamous亚型与TP53和KDM6A的突变相关,同时发现TP53和KDM6A与ASCOM复合物的MLL2和MLL3之间存在相互作用(如图2b)。之前的免疫组织化学已经发现在胰腺squamous肿瘤中就存在高表达的TP63,本文RNA-seq研究发现高表达的TP63∆N(TP53突变体)以及对应的目标基因是这类亚型的一个很重要的特征(图2c)。squamous亚型还与控制胰腺内胚层细胞的基因的甲基化以及下调有关,最终会导致内胚层特征的丧失(如图2d)。
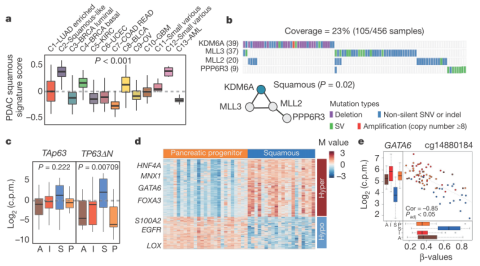
图2 squamous亚型的分子特征。a. 对squamous亚型的特征分数做箱线图;b. 通过HotNet2发现一个突变基因的子网络;c. TAp63和TP63∆N在四种亚型中的表达水平箱线图;d. 差异甲基化热图;e. GATA6超甲基化与GATA6基因表达做相关性分析,发现GATA6超甲基化与GATA6基因表达下调相一致。
1、 另外三种亚型的特征描述
文章通过转录调控网络的其他转录因子分别对其他三种亚型进行界定,其中,通过聚类分析发现,在immunogenic亚型中,9中不同的免疫细胞类型或表型相关的基因表达上调(如图3a),同时,CTLA4和PD1基因在获得性癌症免疫抑制通路中的表达上调(如图3c)为新型免疫调节剂的产生提供了理论基础。
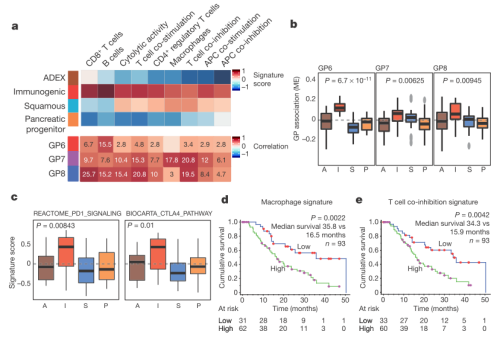
图3 PDAC免疫途径。a. 热图反映了PDAC中免疫细胞/表型基因特征的富集,单元格内的数字代表相关系数的-log10值;b. 对不同亚型的GP基因簇的ME得分做箱线图;c. 不同亚型的CTLA4基因特征分数与PD1的箱线图;d.e. Kaplan–Meier分析比较患者高或低的免疫细胞/表型特征分数。
1、 胰腺癌的免疫机制
为了描述激活肿瘤微环境的分子机制,文章将特定免疫细胞群的基因表达谱富集分析与PDAC每个基因簇(GPs)相结合(如图3a),做相关性分析,发现基因簇GP6, GP7和GP8富集在免疫细胞特定基因的表达特征上(如图3a、3b)。很显然,GP6和GP8分别富集在B细胞和CD8+T细胞上,而GP7与巨噬细胞和T细胞共抑制相关。
针对squamous亚型中TP53突变以及TP63表达上调的关系,文章利用胰腺癌转基因小鼠模型来阐明这一现象。对之前做过的突变TP53敲除实验的转录数据进行分析发现,突变TP53调控squamous亚型的转录表达网络,特别是GPs 2和3, 包括PDGFRB(生长因子受体β)(如图4a),另外,图4c-e说明TAp63在squamous亚型中发挥了重要的作用。
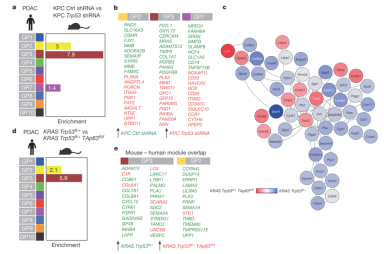
图4 TP53突变以及Tap63的丧失,可以调控与squamous亚型相关的关键GPs基因簇。a. 用Trp53 shRNAs处理的KPC-小鼠细胞株中,重要的GP基因簇不受约束;b. Trp53调控富集在GP2、3、7的基因;c. KRAS Trp53fl/+ 和KRAS Trp53fl/+ Trp63fl/fl细胞株中基因差异表达的子网络,节点的颜色代表基因表达不同;d. KRAS Trp53 fl/+和KRAS Trp53 fl/+ Trp63 fl/fl细胞株的基因差异表达,主要富集在GPs2、3;e. Trp63调控的基因主要富集在GPs2、3基因簇。图a和b中,条形图显著性值取-log10;图b和e中,箭头和颜色代表基因表达上调。
【文章亮点】
(1) 使用大量癌症数据对胰腺癌的病理生理学进行深入分析,细化出新的胰腺癌亚型;
(2) 结合基因组学、表观遗传学、转录组学为未来的癌症治疗体系提供一些有意义的见解;
对癌症的免疫系统的分析,发现了胰腺癌的一个新的亚型,为临床试验提供新的思路。